New Target Discovery : CAGE
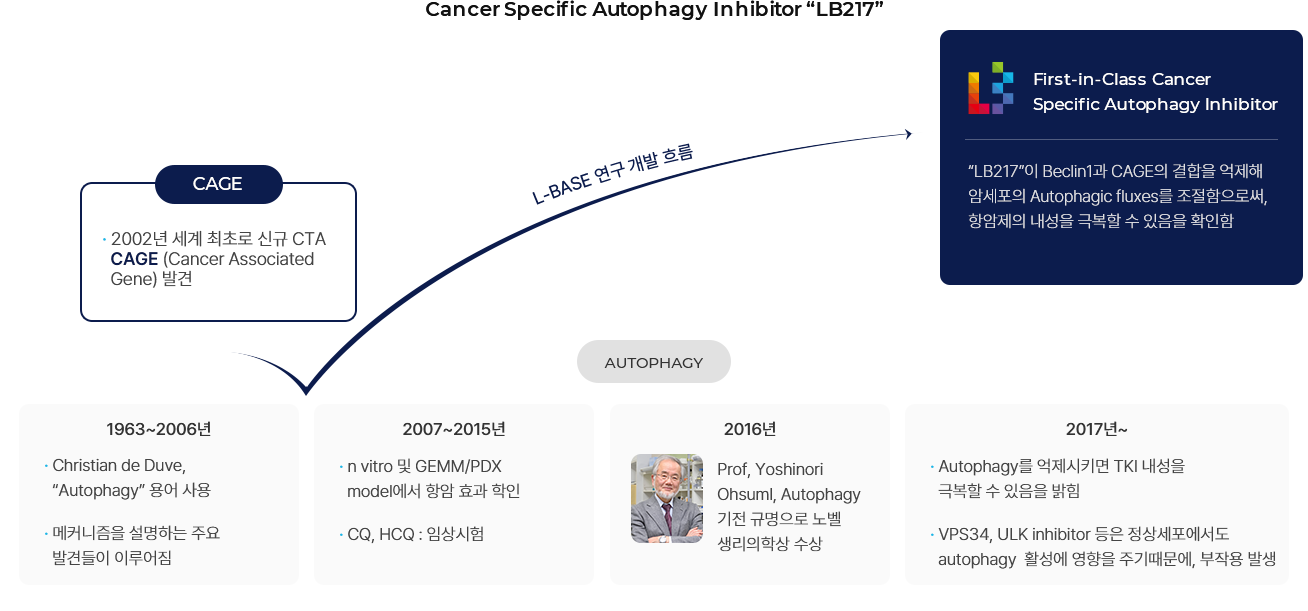
2002년 세계최초로 신규 암정소항원(CTA) CAGE 발견
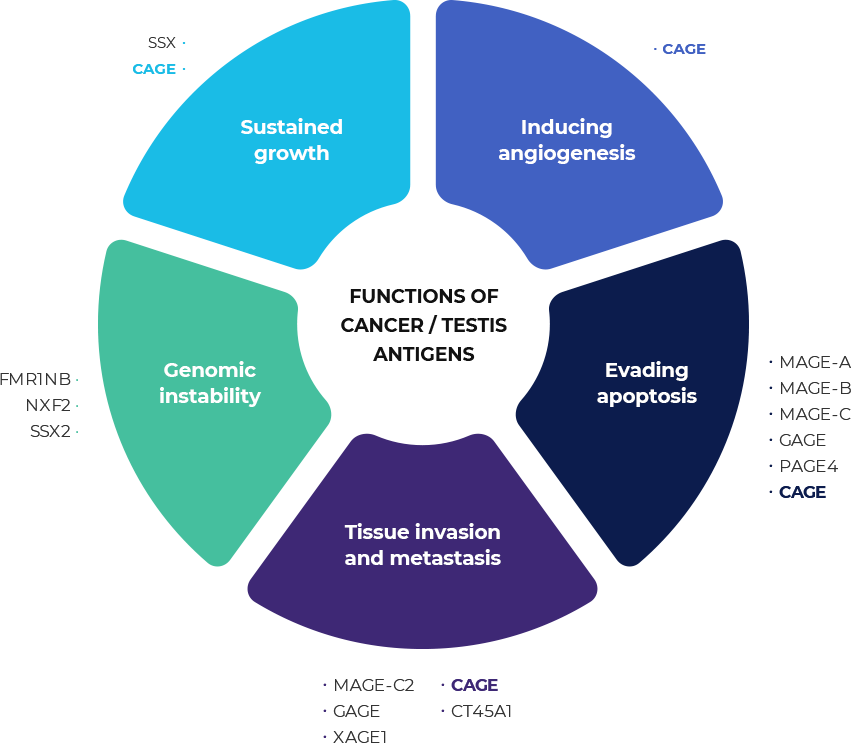
암 정소 항원(CTA, Cancer Testis Antigen) 중 하나인 CAGE(DDX53, CT26, Cancer Associated GEne)는
2002년 처음으로 발견 후 최근 19편의 SCI급 논문을 통해 다양한 암종에서 암이 형성되는 과정 중에 발현하며 자가포식작용, 항암제 내성,
암 전이, 혈관 신생 유도, 암 줄기세포 유도 등에 CAGE가 관련되어 있음을 밝혀 유망한 표적임을 입증하였습니다
-
Cancer Associated Gene (CAGE), known as a CT26
-
Exhibits anti-cancer activities and overcomes resistance
mutations for existing anti-cancer drugs -
The DDX53 gene is located on the chromosome Xp22.11
-
Molecular weight: 71154 Da
-
CTA (cancer testis antigen) that provides multiple cancer
activities and related to EGFR -
Encoded by the DDX53 gene
-
Size: 631 amino acids
암 발생에서 CAGE의 역할
CAGE 단백질은 다양한 암 조직에서 발현이 확인되었습니다.
또한, CAGE는 암 세포주에서 자가포식작용 초기 단계에 관여하는 인자인 Beclin1과 결합하여 자가포식작용을 증가시키는 역할을 한다고 보고된 바 있습니다.
비소세포폐암에서 표적항암제인 EGFR TKIs (Tyrosine kinase inhibitors)의 약물내성 기전으로 자가포식작용이 증가하는 현상에서
CAGE가 매개하는 것으로 알려졌으며, EGFR TKIs에 의해 CAGE 발현이 강하게 나타난다고 보고되었습니다.
암 환자의 조직에서 CAGE 발현양상




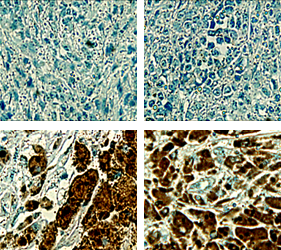
Breast
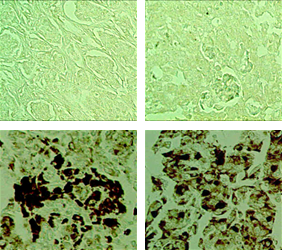
Lung
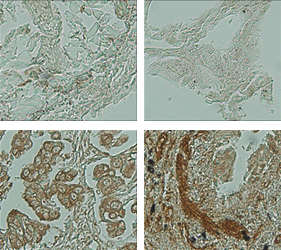
Liver
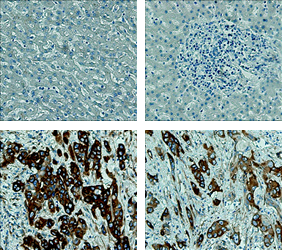
Skin
| Tissue | Type | |||
|---|---|---|---|---|
| Normal (adjacent) | Tumor | |||
| Positive (*) | Negative (*) | Positive (*) | Negative (*) | |
| Skin | 0/24 (0%) | 24/24 (100%) | 15/76 (19.7%) | 61/76 (81%) |
| Liver | 1/10 (10%) | 9/10 (90%) | 26/70 (37.1%) | 44/70 (62.9%) |
| Lung | 2/16 (12.5%) | 14/16 (87.5%) | 40/84 (47.6%) | 44/84 (52.4%) |
| Breast | 2/12 (16.6%) | 10/12 (83.4%) | 46/88 (52.3%) | 42/88 (47.7%) |
암 환자조직의 Tissue microarray 분석결과, CAGE는 유방암, 폐암, 간암, 피부암등에서 과발현되는 것이 확인되었습니다.
Source: THE JOURNAL OF BIOLOGICAL CHEMISTRY VOL. 285, NO. 34, pp. 25957–25968, August 20, 2010
CAGEpep® Platform for
Anti-cancer Drug R&D
Novel Target
PPI screening
Technology

Indications
CAGEpep® Platform은 크게 3가지 핵심 기술로 구성되어 있습니다.
-
01
CAGE와 결합하는 파트너
단백질들의 라이브러리 -
02
protein-protein interaction(PPI)을
저해하는 약물 screening 시스템 -
03
단백질간 결합의 3차 구조 모델링 기반
virtual screening 시스템
CAGEpep® screening system
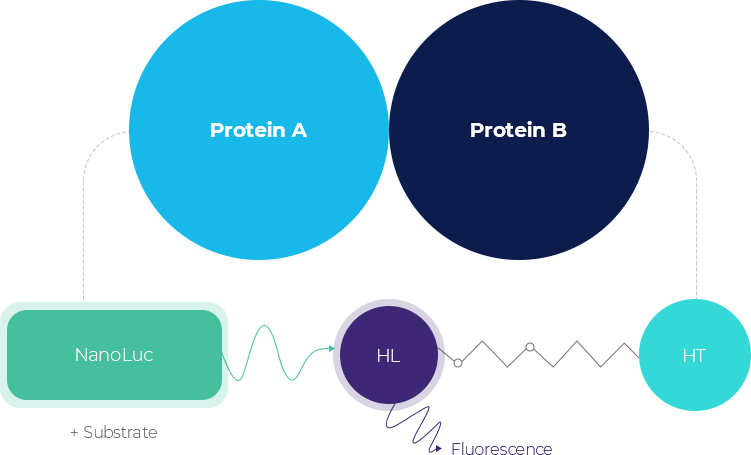
CAGE와 결합하고 있는 단백질에 대한 신약후보물질의 결합억제효과를 스크리닝 할 수 있는 NanoBRET 시스템을 구축하였습니다.
NanoBRET은 세포 내 특정 단백질 간 결합 (PPI)을 조사할 수 있는 분석법으로 CAGE (proteinA)와 Beclin1 (proteinB)을 각각 tag 단백질이 결합된 형태로
세포 내에서 발현시켜 그 결합을 분석하는 기술로 기존의 FRET 기법에 비해 높은 특이성과 정량적 분석이 가능한 장점이 있습니다.
오토파지 (Autophagy) 란?
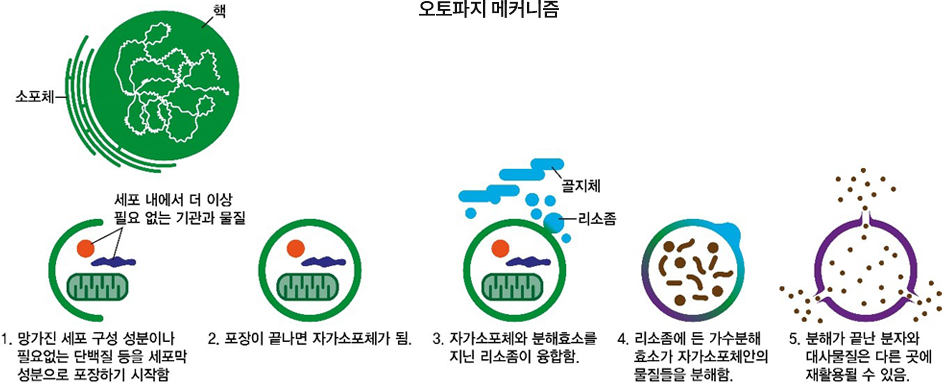
우리 몸은 약 60조 세포로 구성되어 있으며 세포 안에서는 매일 활동에 필요한 에너지와 물질들이 생산되고 있습니다. 그 과정에서 기능이 저하된 세포소기관, 변형된 단백질, 세포질의 노폐물과 같은 쓰레기가 발생을 합니다. 세포 안에서 쓰레기를 치우고 재활용하는 시스템이 존재하게 되는데 그것이 바로 오토파지(자가포식)입니다.
오토파지는 그리스어로 ‘스스로(auto), 먹는다(phagy)’는 뜻의 단어가 합쳐진 것으로 우리말로는 ‘자가포식’이라 부릅니다. 1992년 일본의 ‘오스미 요시노리 교수(Yoshinori Ohsumi)’가 단세포 생물인 효모 내부에서 이루어지는 오토파지 과정을 보고하였고, 이듬해 관련 유전자 15종을 발견하면서 오토파지가 생물이 살아가는데 중요한 역할을 한다는 사실이 밝혀졌습니다.
오토파지와 암
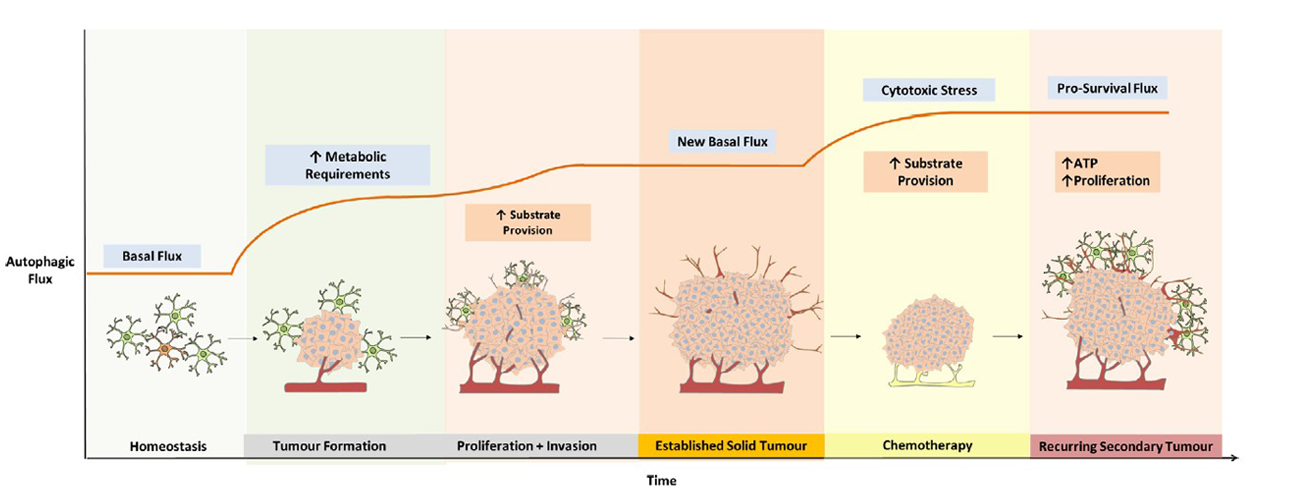 Source: Biochemical Pharmacology Volume 147, January 2018, Pages 170-182
Source: Biochemical Pharmacology Volume 147, January 2018, Pages 170-182
오토파지의 기능이 제대로 작동되지 않아 노폐물이 쌓이게 되면 각종 질병의 단초가 됩니다.
단백질 찌꺼기가 넘쳐 세포 밖으로 나오게 되면 유전자 변이가 일어나 암을 유발할 수 있으며,
뇌에 쌓이게 되면 알츠하이머 치매나 파킨슨병을 일으킬 수도 있습니다.
정상세포가 암세포로 분화되면서 저산소 환경과 영양분 부족 환경에 처하게 되면 스트레스가 심해지면서
세포는 회생 가능성이 낮다고 판단하며 세포자살(apoptosis)경로를 촉진합니다.
이 때 오토파지는 노폐물의 재생을 통해 지속적인 에너지를 공급하고 여러 세포생존 경로를 유지시켜 암 발달 과정에 안정성을 부여하게 됩니다.
오토파지와 항암제 내성
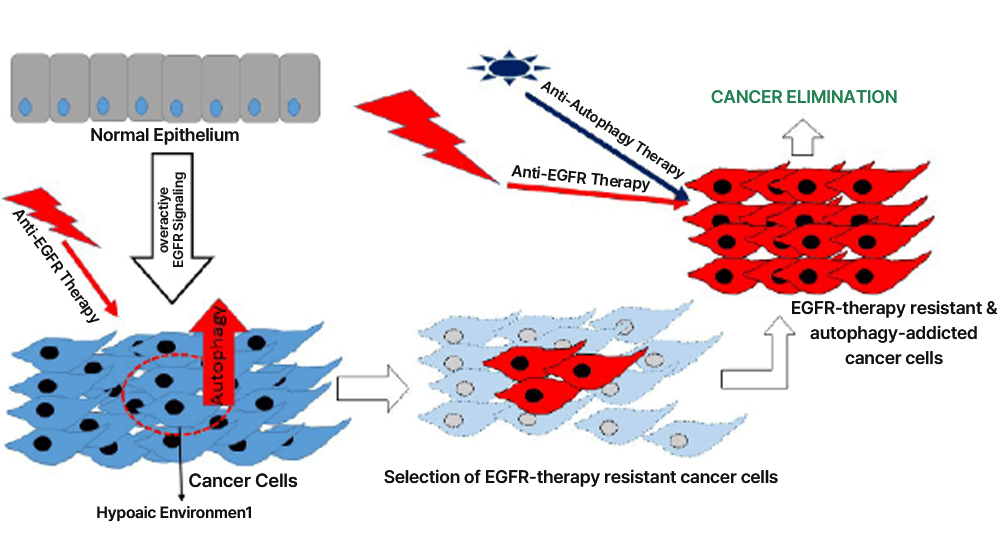 Source: J Adenocarcinoma. 2016, 1(2): 9
Source: J Adenocarcinoma. 2016, 1(2): 9
종양촉진인자로서 오토파지는 기존 항암제의 내성과 관련이 있어 항암제 개발 연구자들의 주목을 받고 있습니다.
일례로, 전이성 또는 진행성 비소세포폐암의 치료제로 사용되고 있는 EGFR TKI (tyrosine kinase inhibitor)의 경우 초기에는
치료에 효과적이나 장시간 투여 시 암세포에서 오토파지 작용으로 인한 내성이 보고되고 있습니다.
이 때 활성화되는 오토파지를 일명 ‘세포보호성 오토파지(protective autophagy)’라 명명하고
활발한 연구가 진행되고 있으며, 폐암 뿐만 아니라 췌장암, 대장암, 유방암, 방광암 등 다양한 암종에서도 보고되고 있습니다.
또한, 오토파지가 면역반응(immune response)에 관련이 되어 있어 오토파지 억제를 통해 CD8+ T 세포, Natural killer(NK)세포와 같은 암세포 살상세포를 활성화시켜
항암 효능을 유도하여 면역항암제에 저항성을 갖는 환자군에 대해 오토파지 저해제와 면역항암제와의 병용요법이 가능합니다.
엘베이스의 차별화 전략
“정상세포에서의 오토파지는 유지하고, 암세포서만 오토파지를 억제해야 한다.”
결국, 오토파지의 억제를 통한 암치료법의 성패에 있어서, 정상세포에서는 작동하지 않고,
암세포에서만 작동하고 있는 세포보호성 오토파지만을 정확히 타깃하는 기술이 중요한 이슈로 대두되고 있습니다.
암세포에서만 오토파지를 켜고, 끄는 스위치를 찾아내는 것이 암세포에서만 선택적으로 오토파지를 끌 수 있는 주요 포인트가 됩니다.
즉, 이 핵심 스위치를 찾아내고, 그 스위치가 조절되는 기전을 밝히게 되면 암에 선택적인 오토파지 저해제를 개발할 수 있습니다.
엘베이스는 암세포의 성장과 전이, 면역회피 등에 중요한 역할을 하는 특정 단백질을 직접 억제하는 신약물질을 개발중입니다.
엘베이스에서 개발단계가 가장 앞서 있는 비소세포폐암 치료 약물후보의 경우, 오토파지를 타겟으로 개발하는 모든 회사들의 숙제인
cytotoxic autophagy 와 cytoprotective autophagy 의 구별문제를 해결한 혁신적인 신약후보물질입니다.